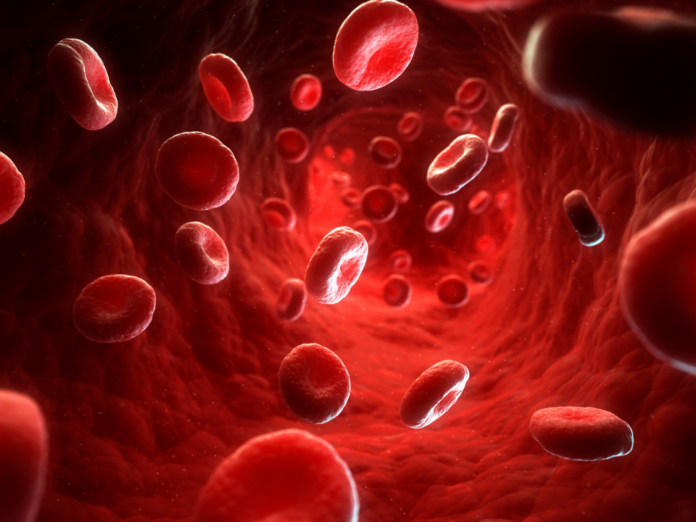
Ao contrário do que você provavelmente aprendeu na escola, transportar oxigênio não é a única função dos glóbulos vermelhos. Em estudo publicado na Science Translational medicine, pesquisadores mostram que essas células, as mais abundantes em circulação, também alertam o sistema imunológico para a presença de bactérias, parasitas e DNA mitocondrial livre de células circulantes, o que pode significar doença grave, como sepse ou pneumonia. Esse papel de detecção de patógenos tem um custo, entretanto: os glóbulos vermelhos (RBCs) que carregam fragmentos de DNA são mortos, provavelmente contribuindo para a anemia associada à inflamação.
Quando Nilam Mangalmurti, médica intensivista e pesquisadora da Universidade da Pensilvânia, era bolsista de terapia intensiva pulmonar em 2005, ela se interessou em saber como as hemácias transfundidas poderiam causar lesões pulmonares. Essa pesquisa forneceu uma das primeiras dicas de que os eritrócitos poderiam interagir com o sistema imunológico, mas isso ocorreu no contexto das células transfundidas.
Ao longo da última década, porém, a equipe de Mangalmurti e outros grupos descobriram que tanto hemácias transfundidas quanto circulantes não são apenas bolsas de hemoglobina, mas “na verdade têm uma infinidade de funções de troca não-gasosa”, diz ela, que “provavelmente têm um efeito na resposta do host que simplesmente ignoramos por todos esses anos. ” Em 2018 , por exemplo, seu grupo mostrou que RBCs usam TLR9 para limpar o DNA mitocondrial livre de células, que está presente em níveis baixos durante a renovação celular normal e circula em níveis elevados durante a doença ou morte celular extensa.
Após a publicação em 2018, os pesquisadores tinham algumas questões em aberto. Primeiro, eles queriam saber onde está o TLR9, um receptor envolvido na resposta imune, nas hemácias. No novo estudo, eles mostram que os domínios de ligação ao DNA de TLR9 podem ser encontrados na superfície celular de RBCs humanos e de camundongo. Eles também descobriram que, normalmente, algum TLR9 é detectável em uma pequena porcentagem de eritrócitos saudáveis, mas em pacientes com sepse ou malária, mais de 40 por cento dos eritrócitos tinham TLR9 detectável em suas membranas.
Mudanças nos níveis de proteína de superfície são inesperadas porque os eritrócitos não têm núcleos e, portanto, não podem alterar sua expressão de genes e consequentes níveis de proteína com base em pistas ambientais. Para entender o que estavam vendo, os autores trataram RBCs in vitro com DNA. Eles descobriram que as células sofreram alterações em suas membranas e assumiram formas estranhas que expuseram mais domínios de ligação de ácido nucleico TLR9, o que provavelmente explica o aumento visto em amostras de sangue de pacientes.
Mangalmurti e colegas também usaram a coloração de anticorpos para mostrar que essas alterações morfológicas mascaram o antígeno CD47 que os RBCs exibem. O CD47 atua como um emblema da empresa para indicar ao sistema imunológico que as células vermelhas pertencem – o chamado senso de identidade. Sem isso, eles podem parecer estrangeiros. De fato, os pesquisadores expuseram hemácias a DNA ou solução salina e, em seguida, infundiram as células em camundongos. Em poucas horas, as células expostas ao DNA foram engolfadas por glóbulos brancos no baço dos animais, o que desencadeou aumentos nos sinais imunológicos inatos, como o interferon, no baço.
A retirada de hemácias da circulação também parece ter um papel na anemia, que é comum em pacientes em unidades de terapia intensiva. Em pessoas com sepse e anemia, os pesquisadores encontraram mais DNA associado a hemácias do que em pacientes com sepse que não tinham anemia. Também foi demonstrado que o DNA mitocondrial circulante aumenta durante as infecções por COVID-19. Quando os autores observaram, eles descobriram que a quantidade de DNA mitocondrial preso às células vermelhas estava correlacionada com a gravidade da doença em pacientes com COVID-19.
Em condições normais, os eritrócitos vivem 120 dias em circulação, ocasionalmente captando DNA e depois são eliminados, explica Mangalmurti. “Mas quando há um insulto inflamatório agudo, eles estão realmente pegando o DNA, perdendo seu senso de identidade, ficando limpos e desencadeando a resposta imunológica inata.” Em pacientes gravemente enfermos, isso pode resultar em anemia inflamatória aguda e eritrócitos de formato estranho, que os médicos vêm observando há anos sem entender por quê.
“O papel dos eritrócitos na detecção de patógenos é frequentemente esquecido”, escreve Sizun Jiang, que investiga as interações entre a doença do hospedeiro no Beth Israel Deaconess Medical Center e na Harvard Medical School e não esteve envolvido no trabalho, escreveu em um e-mail para o The Scientist. “Os autores fizeram um trabalho fantástico ao identificar o TLR9 na superfície das RBCs, acrescentando ao crescente número de estudos que desafiam a visão tradicional” de que o TLR9 só é encontrado dentro das células, acrescenta.
“O estudo indica que os glóbulos vermelhos podem servir como células imunológicas inatas”, não apenas transportadores de oxigênio, diz Rio Sugimura, engenheiro biomédico da Universidade de Hong Kong que não participou do estudo. O grupo de Sugimura produz glóbulos vermelhos mais facilmente do que células T em laboratório, diz ele, o que levanta a possibilidade de que os eritrócitos possam ser projetados para preparar as defesas imunológicas contra patógenos ou outros ataques.
Outra aplicação potencial, de acordo com Rafael Polidoro Alves Barbosa, imunologista da Indiana School of Medicine que não participou do estudo, é “desenvolver biomarcadores precoces de inflamação sistêmica”. Se os pesquisadores pudessem detectar um aumento na população de eritrócitos com ácido nucléico positivo e rastrear seus níveis ao longo do tempo, ele explica, isso poderia sinalizar a necessidade de intervenção sem a necessidade de testes diagnósticos mais complexos.
Mangalmurti concorda que existe potencial para diagnósticos e terapêuticas. “Só de pensar sobre essas células vermelhas de forma diferente e como essas descobertas podem se aplicar a diferentes doenças é muito divertido”, diz ela. Nas infecções por COVID-19, por exemplo, as pessoas infectadas com o mesmo patógeno têm respostas diferentes. “Os glóbulos vermelhos podem ser muito diferentes em pacientes diferentes”, o que pode ajudar a explicar a variação na gravidade da doença, explica ela. “Eu realmente espero que este seja o início de muito mais pessoas olhando para os glóbulos vermelhos e sua função imunológica.”
Fonte: The Scientst