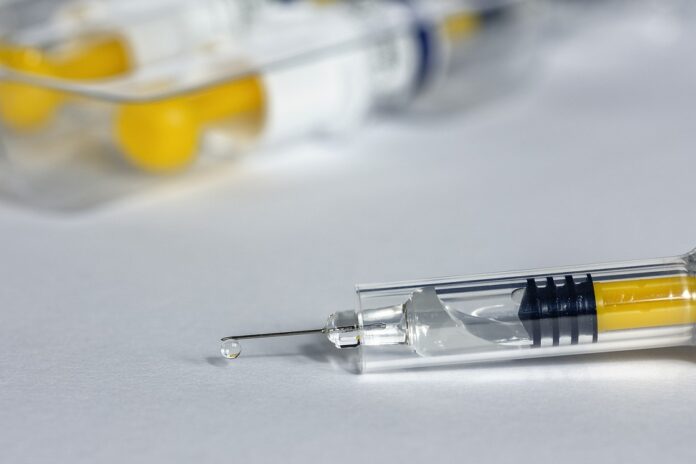
As fabricantes Pfizer e BioNTech descreveram a novidade nesta segunda-feira (9/11) como um “grande dia para a ciência e para a humanidade”.
A vacina foi testada em 43,5 mil pessoas de seis países e, em setembro, a Anvisa (Agência Nacional de Vigilância Sanitária) autorizou que seus testes clínicos fossem ampliados no Brasil, de mil para dois mil testes em voluntários.
Segundo as fabricantes, nenhum problema de segurança na vacina foi levantado até o momento.
As empresas planejam solicitar, até o final deste mês, uma aprovação emergencial para uso da vacina, na expectativa de que a imunização ajude os países a reduzir as medidas de restrição de circulação em vigor.
Há cerca de uma dúzia de vacinas contra a covid-19 nas fases finais de testagem (chamadas de fase 3), mas essa é a primeira a apresentar resultados efetivos relacionados à prevenção. No Brasil, outra vacina em desenvolvimento, a CoronaVac, pelo Instituto Butantan, está justamente na etapa de investigar se ela é capaz de proteger contra a covid-19, depois de testes prévios terem indicado que ela é segura.
A vacina da Pfizer é diferente porque usa uma abordagem completamente experimental: envolve injetar parte do código genético do vírus de modo a treinar o sistema imunológico do indivíduo.
Testes prévios apontaram que a vacina treina o corpo a fazer tanto anticorpos quanto, em outra parte do sistema imune, as chamadas células T para combater o coronavírus.
São necessárias duas doses da vacina, com três semanas de diferença entre elas. Os testes (feitos, além do Brasil, em Alemanha, EUA, Argentina, África do Sul e Turquia) apontaram uma proteção de 90% depois da segunda dose.
No entanto, é importante destacar que ainda não se sabe qual a duração dessa imunidade.
As fabricantes afirmam que serão capazes de prover 50 milhões de doses ao final deste ano e 1,3 bilhão até o fim de 2021.
Mas há desafios logísticos importantes para isso: as vacinas precisam ser armazenadas em refrigeradores ultrafrios, a menos 80°C.
OMS: Notícia é boa, mas ‘não vai virar o jogo’
Questionado pela BBC sobre o avanço, o enviado especial da OMS (Organização Mundial da Saúde) de covid-19, David Nabarro, afirmou que se trata de uma ótima notícia, mas que a vacina, “embora ajude, não vai virar completamente o jogo” na pandemia.
Ele afirmou que a vacina ainda terá de passar pelos processos regulatórios e que ainda há “muitos passos” antes que autoridades possam atestar com segurança que a imunização é “segura e eficiente”, o que ainda pode levar alguns meses.
Nabarro também pediu que, mesmo que a vacina seja aprovada, as pessoas mantenham as medidas de segurança e isolamento social para impedir a circulação do coronavírus.
“Quero reforçar que esses princípios continuam sendo absolutamente essenciais mesmo que uma vacina chegue nos próximos meses”, declarou.
Já o professor emérito de Medicina da Universidade de Oxford John Bell afirmou à BBC que a notícia lhe trouxe confiança de que a vida poderá voltar à normalidade na primavera do hemisfério Norte, ou seja, no final do primeiro trimestre do ano que vem.
Outro professor da mesma universidade, Peter Horby, afirmou que o anúncio desta segunda-feira o fez “sorrir de orelha a orelha”.
“É um alívio. (…) Ainda temos um longo caminho até que as vacinas comecem a fazer uma diferença real, mas este parece ser um divisor de águas”.
Resultados são preliminares
Os dados apresentados pela Pfizer ainda não são finais: são baseados nos testes com 94 voluntários que desenvolveram covid-19.
A porcentagem da eficiência exata da vacina pode, portanto, mudar quando os resultados completos forem divulgados.
As empresas afirmam que esses dados podem estar prontos nas próximas semanas, quando seria possível encaminhar a vacina para os órgãos reguladores.
Até lá, não é possível iniciar campanhas de vacinação nos países.
Fonte: BBC News