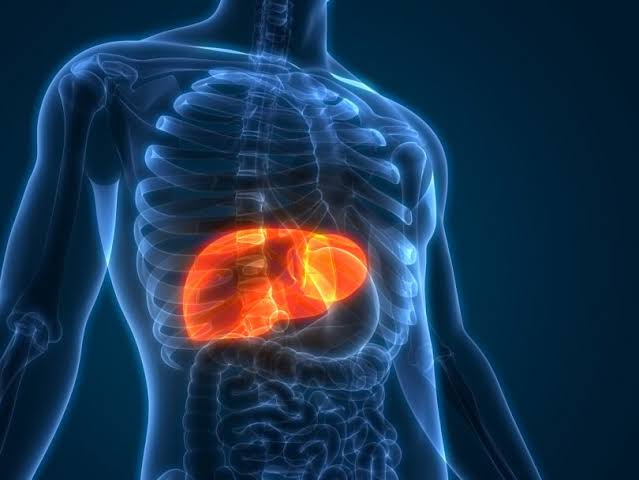
Cientistas chineses conseguiram transformar o baço de um camundongo em um fígado funcional, acenando com uma potencial nova esperança para os doentes que sofrem devido à escassez de órgãos para implante por todo o mundo.
Para aproximadamente dez milhões de pessoas com falhas nos órgãos em estado terminal, um implante que substitua um órgão danificado por outro novo pode ser a última esperança de sobrevivência. Entretanto, a falta de doadores, rejeição imunológica e inúmeros outros fatores clínicos, éticos e econômicos tendem a fazer com que a fila de espera seja muito longa. E muitos não conseguem chegar ao final dela.
Nas últimas três décadas, a engenharia de tecidos (ET) prometeu criar tecidos funcionais a partir de tubos de ensaio. Essa abordagem cria culturas de células em suportes tridimensionais, induzindo-as a se diferenciarem no tecido desejado e,por fim, realizando o transplante desse tecido vivo de volta ao corpo, substituindo assim o órgão danificado. “O objetivo da ET é restaurar a função através da entrega de elementos vivos que se integram ao paciente”, escreveram Joseph Vacanti e Robert Langer, dois pioneiros na medicina regenerativa, num artigo manifesto publicada na Lancet, em 1999.
Essa abordagem teve um avanço notável em promover soluções promissoras para reparar estruturalmente tecidos mais simples. Entretanto, no caso da regeneração de órgãos vitais e complexos, como o fígado, a ET ainda tem muito para evoluir. A estrutura de um órgão como o fígado é muito complicada para ser replicada com as tecnologias atuais — principalmente seus vasos sanguíneos abundantes, abertos e organizados, que o conectam ao corpo para o suprimento de nutrientes. Protótipos simplificados, feitos em experimentos de laboratório, não sobreviveram após o transplante, carecendo de um fornecimento adequado de sangue.
Para vencer este desafio, a equipe de pesquisadores, que pertencem à Universidade de Nanjing e à Universidade de Macau, adotou uma maneira diferente de pensar. Ao invés de criar um órgão para transplante, eles optaram por transformar diretamente um órgão que já existia — o baço — em um “novo” órgão que cumpre o papel do fígado no organismo do camundongo. Os pesquisadores injetaram um tecido pré-selecionado extraído do baço do camundongo, que apresenta respostas imunológicas menores e produz mais matrix extra-celular necessária para o crescimento celular. Depois implantaram células de fígado humanas e de camundongos dentro do baço remodelado no animal. Ao longo de meses, eles observaram que essas células não apenas sobreviveram a rejeição imunológica como se desenvolveram até formar estruturas semelhantes ao fígado. E, mais importante, essas estruturas exerceram a função do fígado no corpo do hospedeiro. Talvez a descoberta mais empolgante tenha sido a constatação de que o baço transformado em fígado pode salvar a vida de um camundongo que teve 90% de seu fígado original removido.
Essa pesquisa foi publicada online na revista Science Advances com o título “Transformando o baço in vivo em um órgão semelhante ao fígado”. Autor principal do trabalho, Lei Dong, da Universidade de Nanjing, acredita que essa tecnologia poderia “resolver simultaneamente os desafios fundamentais na área da engenharia de tecidos, incluindo a escassez de células, a rejeição por parte do sistema imunológico e a falta de vasos sanguíneos”. Dong ressalta que essa nova abordagem se concentra na restauração da função do tecido in vivo, o que deveria ser o objetivo original da engenharia de tecido, ao invés de focar demais na questão da estrutura do tecido. Chunming Wang da Universidade de Macau, autor cocorrespondente da pesquisa, ressalta a segurança da nova estratégia: “não observamos qualquer resposta adversa durante oito semanas, como rejeição imunológica ou um vazamento indesejado das células transportadas para outras partes do corpo”, o que indica que o potencial de translação da nova estratégia. Os autores estão confiantes que sua abordagem irá superar os obstáculos a longo prazo na medicina regenerativa e, por fim, ajudar a regenerar órgãos maiores “por demanda”.
Fonte: Site Scientific American Brasil