No Brasil, não é incomum comer tatu, que dizem ter gosto de frango. Mas uma nova pesquisa adverte contra a prática, que pode provocar hanseníase.
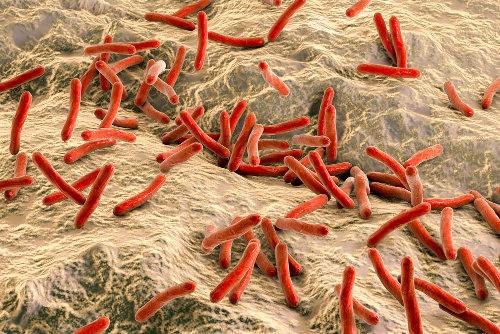
Em um estudo publicado recentemente na revista PLoS Neglected Tropical Diseases, pesquisadores descobriram que 62% dos tatus-galinha amostrados do estado do Pará, no Brasil, apresentaram sinais de exposição à bactéria que causa a hanseníase, também conhecida como lepra ou doença de Hansen.
Além disso, o estudo constatou que as pessoas que comem carne de tatu-galinha com mais frequência apresentam maiores concentrações de anticorpos contra a hanseníase no sangue, sugerindo uma forte correlação entre a caça, o manejo e a ingestão desses animais e a contração da doença.
Um prato consumido em certas áreas pode ser particularmente problemático: ceviche de fígado de tatu, uma mistura de carne crua e cebola. Foi demonstrado que as bactérias causadoras da lepra se concentram no fígado, assim como no baço.
Os pesquisadores testaram 146 residentes locais e descobriram que 92 deles tinham anticorpos contra a bactéria da lepra, sugerindo ampla exposição.
Cerca de 65% das pessoas nessa parte do Brasil comem tatu pelo menos uma vez ao ano, diz John Spencer, imunologista da Colorado State University e autor mais experiente do estudo. “Isso já é muito”, ele diz. “Não sei se 65% dos americanos comem lagosta uma vez ao ano”. (E, muito provavelmente, não comem, sugere pesquisa).
Tatus-reservatório
Os cientistas suspeitam desde a década de 1970 que os tatus podem hospedar e transmitir a bactéria responsável pela hanseníase, conhecida como Mycobacterium leprae. Mas foi apenas em 2011 que a genética revelou uma correspondência entre as estirpes presentes em pessoas e tatus, em lugares como o Texas e a Louisiana. Foi a prova cabal, por assim dizer, de que as duas espécies estavam passando bactérias de um lado para outro.
Felizmente para as pessoas no sul dos Estados Unidos, apenas cerca de um quinto dos tatus-galinha de lá parece carregar sinais de lepra. No Pará, a prevalência de hanseníase em tatus é mais que o triplo.
Os Estados Unidos registram cerca de 200 casos de lepra a cada ano – apenas 25% deles estão associados a tatus. Mas o Brasil registra cerca de 25 mil casos por ano, o que pode ser um número subestimado, de acordo com a pesquisa de Spencer.
E, embora seja verdade que os tatus podem servir como um reservatório para a lepra que às vezes pode passar de volta para os humanos, vale a pena notar que fomos nos que lhes passamos a doença em primeiro lugar. “As pessoas trouxeram a lepra da Europa, com os navios que vinham dos colonizadores”, diz Spencer. (Relacionado: “A lepra foi espalhada pelo colonialismo e pelo tráfico de escravos”)
“Tem gosto de frango”
Enquanto o consumo de carne de tatu pode parecer estranho, a prática é relativamente comum em lugares onde os tatus são abundantes e outras fontes de proteína são escassas.
Em português, a espécie é conhecida como tatu-galinha por causa do sabor da carne, diz Danilo Kluyber, veterinário-chefe do Projeto de Conservação do Tatu-canastra, patrocinado pelo zoológico de Naples, na Flórida.
Embora o tatu-galinha seja o favorito, algumas espécies de tatu-de-rabo-mole e grande-tatu-peludo também são procuradas por sua carne. O tatu-peba também é um alimento popular porque eles prontamente comem qualquer coisa que lhe for servida, de forma que pode ser mantido em cativeiro e engordado, como um pequeno porco cascudo.
Ao fazer isso, as pessoas às vezes lidam e até banham os animais, aumentando o risco de transmissão bacteriana, observa o estudo.
A boa notícia é que os tatus-galinha são abundantes o suficiente para ganhar um status de “pouco preocupante” na listagem da União Internacional para a Conservação da Natureza (IUCN), que avalia espécies ameaçadas de extinção. No entanto, nem todas as espécies de tatu têm tanta sorte, com várias outras espécies nativas do Brasil entrando para a Lista Vermelha de Espécies Ameaçadas da organização, incluindo o tatu-canastra e o tatu-bola-da-caatinga.
Grandes descobertas, pequenos dados
James Loughry, um especialista em tatu afiliado à IUCN, considerou o novo artigo importante “porque demonstra que o mesmo tipo de coisas está acontecendo em outros lugares, fora dos Estados Unidos”.
No entanto, ele teme que, como os pesquisadores conseguiram analisar apenas 16 tatus e 146 humanos, os resultados podem estar sujeitos a mudanças com uma amostragem mais ampla.
Spencer diz que o governo brasileiro concedeu permissão a ele e a seus colegas para coletar apenas 30 tatus no total. No entanto, a equipe teve que contar com caçadores locais, que deixaram parte de sua caça para ser analisada, algo que apenas um punhado deles estava disposto a fazer – talvez por medo de se meter em encrencas.
Isso porque é ilegal caçar qualquer tipo de vida selvagem no Brasil, de acordo com a lei federal.
“Mas se você é pobre e precisa de proteína em sua dieta, faz-se o que for preciso”, diz Spencer.
Saiba mais sobre a Hanseníase
A Hanseníase (Lepra, Mal de Hansen, Doença de Hansen) é uma
doença infecto-contagiosa crônica, existente e estigmatizante desde os tempos
bíblicos e que comporta um preconceito grande até os dias atuais, embora seja
curável.
Acomete, principalmente, pele e nervos periféricos, mas qualquer
órgão do corpo humano, com exceção do sistema nervoso central, pode ser
acometido. Se não for tratada precoce e adequadamente, pode evoluir para
deformidades físicas graves, por causa do comprometimento de nervos
periféricos, gerando auto-segregação do paciente de seu ambiente familiar, social
e profissional.
A Hanseníase é causada pelo Mycobacterium leprae, também
denominado bacilo de Hansen, que apresenta tropismo principalmente por células
cutâneas e nervosas periféricas (Azulay e Azulay, 1997; Bechelli e Curban, 1988;
Cucé e Neto, 1990; Jopling e McDougall, 1991; Brasil Ministério da Saúde, 1994;
Sampaio, Castro e Rivitti, 1983 e Talhari e Neves, 1997).
Trata-se de uma micobactéria, com a forma de bastonete reto ou
ligeiramente encurvado, identificada por Gerhardt Amauer Hansen em 1873 (Cucé
e Neto, 1990). Atinge, principalmente, pele e nervos periféricos, mas pode atingir
praticamente todos os órgãos e sistemas em que haja macrófagos, excetuandose
o sistema nervoso central (Azulay e Azulay, 1997).
Ao exame baciloscópico, os bacilos podem apresentar-se
uniformemente corados (sólidos), irregularmente corados (fragmentados) ou
granulosos. O aspecto irregular e granuloso parece indicar sofrimento bacilar,
sendo observado em doentes em tratamento por ação medicamentosa (Talhari e
Neves, 1997).
Não cresce em meios de culturas artificiais, mas é inoculável em
camundongo e em certos tatus, reproduzindo neles doença comparável à humana
(Azulay e Azulay, 1997). Como não é possível cultivá-lo, não há como produzir,
até o presente momento, vacinas especificas contra esta moléstia.
O período de incubação, ou seja, o tempo decorrido entre o contato
com o bacilo de Hansen e o desenvolvimento dos sintomas é longo. Estima-se
algo entre dois e sete anos, com média entre três e cinco anos (Brasil Ministério
da Saúde, 1994 e Talhari e Neves, 1997).
A principal fonte de infecção é o homem, através das formas
contagiantes da doença (dimorfa e virchowiana), uma vez que somente elas são
capazes de eliminar bacilos para o meio exterior, pois possuem carga bacilar em
quantidade considerável nas mucosas e na derme.
A transmissão se faz pelo contato direto, embora haja a possibilidade
de se processar por método indireto (objetos contaminados, vetores). As principais
fontes de infecção são as mucosas das vias aéreas superiores e os hansenomas
ulcerados, mas também são descritos o leite materno, a urina e as fezes. O papel
de insetos, atuando como vetores, é discutível (Talhari e Neves, 1997).
As vias aéreas superiores são consideradas a principal porta de
entrada do bacilo de Hansen. A inoculação também pode ocorrer por via cutânea
quando existem lesões ulceradas ou traumáticas na pele (Brasil Ministério da
Saúde, 1994).
Após atravessar a barreira tegumentar, o M. leprae aloja-se nos
gânglios linfáticos. Deles partem êmbolos micobacterianos que vão alojar-se na
pele, nervos periféricos e/ou órgãos. Conforme a imunidade celular do paciente, a
doença poderá desenvolver-se de forma mais branda ou mais grave. Existe uma
correlação bem nítida entre as formas clinicas da doença e o estado imunológico
do doente (Azulay e Azulay, 1997; Talhari e Neves, 1997).
Fato importante a ressaltar sobre a Hanseníase é que, mesmo
convivendo com doentes das formas contagiantes dimorfa e virchowiana, a
maioria das pessoas não adoece. Estima-se que 90% das pessoas tenha defesa
natural contra o M. leprae (Talhari e Neves, 1997).
Essa resistência natural do indivíduo parece ter uma predisposição
genética. Rotberg, pesquisador brasileiro, chamou de fator N (natural) a um fator
que existiria congenitamente na maioria dos indivíduos (85 a 90% da população)
e que estaria relacionada à resistência. Os não portadores do fator N cairiam na
margem anérgica de Rotberg (10 a 15%), aonde estariam aqueles que
desenvolveriam as formas graves da doença (Azulay e Azulay, 1997).
A Hanseníase não tem predileção por sexo ou raça. Alguns
trabalhos apontam para um maior número de casos masculinos descritos, mas
isto pode traduzir maior movimentação e oportunidade profissional dos homens.
além de um exame físico menos cuidadoso nas mulheres. Em comunidades em
que não existem tabus sociais, e a movimentação das mulheres é similar a dos
homens, e não existem diferenças no exame médico realizado, não são
encontradas variações por sexo no número total de doentes (Talhari e Neves,
1997).
Essa moléstia não tem uma distribuição geográfica uniforme, existindo
diferenças em nível continental, nacional e local, mas todos os países com maiores
coeficientes de prevalência se encontram em regiões menos desenvolvidas:
América Latina, África e Ásia.
Para Bechelli e Curban (1988), no meio familiar (contatos
intradomiciliares) o contágio ocorre cinco a oito vezes mais freqüentemente do que
no meio extradomiciliar. Os casos em menores de um ano são raros. A cura
espontânea da Hanseníase na infância não é incomum.
Em se tratando de uma doença de evolução insidiosa e de
grande potencial incapacitante, o diagnóstico precoce é de
fundamental importância e deve ser o primeiro objetivo das
ações de controle da Hanseníase (Brasil Ministério da Saúde,
1994, p.17).
A anamnese, o exame clínico cuidadoso das lesões cutâneas e a
pesquisa da sensibilidade nervosa periférica permitem. quase sempre, o
diagnóstico da Hanseníase. Toda superfície cutânea deve ser examinada.
Entretanto, existem exames que podem ser usados como auxiliares
no diagnóstico dessa moléstia. Os mais usados são o exame baciloscópico e o
exame histopatológico, que serão relatados a seguir. Convém citar, ainda, a
existência dos testes da histamina e pilocarpina que, não sendo mais utilizados na
rotina diagnóstica, não serão especificados. O teste de Mitsuda era usado até
recentemente, há cerca de dois anos, e auxiliava na classificação das formas
clinicas da doença.
Ressalta-se a superioridade do diagnóstico clinico, mediante exame
dermato-neurológico, sobre os exames laboratoriais complementares (Brasil
Ministério da Saúde, 1994).
Para Yamashita et al. (1996), o diagnóstico da Hanseníase baseia- se
nos sinais clínicos e nos achados laboratoriais, porém, nenhum exame laboratorial
atualmente utilizado pode ser considerado completo, isto 6, capaz de diagnosticar
e classificar a forma clinica da Hanseníase.
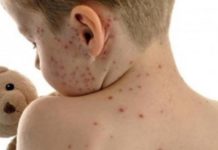
As manifestações cutâneas da Hanseníase são polimorfas, ou seja,
variadas. Conforme a forma clinica da doença (indeterminada, tuberculóide,
dimorfa ou virchowiana), teremos diferentes lesões cutâneas. Elas serão
abordadas no item classificação clínica da Hanseníase e manifestações
cutâneas.
A sensibilidade normal da pele depende da integridade dos nervos e
das finas terminações nervosas periféricas, encontradas sob a pele. É de
fundamental importância para a preservação da integridade e da função dos olhos,
mãos e pés (Brasil Ministério da Saúde, 1994).
Na Hanseníase há perda de sensibilidade térmica, por primeiro, a
seguir, da dolorosa e, por fim, da tátil, acarretando hipo ou anestesia cutânea.
Sempre deve ser pesquisada a área com suspeita de lesão, comparando-se com
outra área de pele normal.
Sensibilidade Tátil
Toca-se com um chumaço de algodão, embebido em éter, a pele sã
e a área suspeita. O éter aplicado sobre a pele causa a sensação de frio. Nas
áreas suspeitas de lesão o paciente refere como “menos frio” (hipoestesia) ou
ausência de frio (anestesia).
Sensibilidade dolorosa
É verificada por meio de uma agulha de injeção, tocando-se a ponta e o cabo da mesma. Também pode ser utilizado um alfinete, tocando-se com a ponta ou a cabeça do mesmo. 0 paciente deve informar qual a parte do instrumento está sendo tocada sobre sua pele.
A baciloscopia deve ser realizada em todos os pacientes com
suspeita clinica de Hanseníase, mas nem sempre evidencia-se o M. leprae nas
lesões hansênicas ou em outros sítios de coleta.
A pesquisa do bacilo de Hansen é feita na linfa coletada das áreas
suspeitas, após compressão isquémica do local e pequena incisão da pele com
bisturi. A linfa coletada é corada pela técnica de Ziehl-Neelsen e ao microscópio
óptico observa-se, ou não, a presença dos bacilos corados de vermelho pelo
corante fucsina.
Nas formas clínicas Indeterminada e Tuberculóide a baciloscopia é
negativa, ou seja, não se observam bacilos de Hansen e não há risco destas
formas contagiarem. As formas Dimorfa e Virchowiana são positivas e, por isto,
são as responsáveis pela transmissão da doença.
Exame Histopatológico
Na classificação do paciente de Hanseníase, quanto à forma clínica,
deverão ser utilizados os critérios clínicos e baciloscópicos. Quando houver
necessidade, o exame histopatológico poderá ser usado para elucidação
diagnóstica, tendo-se sempre em vista que a clínica é soberana.
Após coleta de pequeno fragmento de pele por técnica de biópsia
com punch ou bisturi, este é enviado para laboratório que processa a lâmina para
ser examinada ao microscópio óptico. Conforme a forma clínica da Hanseníase,
teremos diferentes achados histopatológicos característicos.
Teste de Mitsuda
O teste de Mitsuda, realizado mediante injeção intradérmica de 0,1 ml
de antígeno lepromínico, indica a defesa imunológica do paciente ao bacilo de
Hansen. Seu valor é prognóstico e não diagnóstico. Baseia-se em uma reação
imunológica retardada do tipo celular de alta especificidade para o M. leprae.
Pacientes Mitsuda positivos, ou seja, que formam lesão no local da
injeção (pápula eritematosa ou úlcera) apresentam boa defesa imunológica e,
mesmo que adoeçam, evoluirão para formas benignas da doença. Os pacientes
Mitsuda negativos (sem reação local) têm chances de evoluírem para as formas
graves da doença (dimorfa e virchowiana). A leitura do local da inoculação deverá
ser realizada entre a terceira e a quarta semanas após a injeção (Brasil Ministério
da Saúde, 1994).
PROFILAXIA
A profilaxia da Hanseníase visa ao controle da doença. No passado,
era feita de forma errônea e estigmatizante, com separação de famílias e dos
45
filhos de doentes. Hoje, procura tornar o paciente um aliado das equipes de saúde.
Os enormes preconceitos e as barreiras culturais
milenares, existentes em relação à enfermidade, constituem
forte obstáculo profilaxia, pela não aceitação do doente na
comunidade e pelos ultrapassados conceitos do povo em
relação a doença (Talhari e Neves, 1997, p.151).
A mudança do nome lepra para Hanseníase buscou afastar as
fantasias e os preconceitos sobre a moléstia. Todas as pessoas envolvidas com a
doença devem divulgar, sempre que possível, os novos e atuais conceitos sobre a
Hanseníase: doença curável, de baixa contagiosidade e contra a qual a maioria da
população tem defesas imunológicas naturais.
Basicamente, a profilaxia será alcançada mediante diagnóstico
precoce, tratamento, educação sanitária e acompanhamento dos familiares dos
doentes.
Para realização do diagnóstico precoce, algumas atitudes são
necessárias: conhecimento das áreas endêmicas da doença e priorização do
trabalho nessas regiões, divulgação de informações corretas sobre a doença
população, treinamento das equipes de saúde, exames da coletividade e
acompanhamento dos familiares dos doente.
Os contatos intradomiciliares (que residem sob o mesmo teto há menos de cinco anos) dos doentes de todas as formas clinicas da Hanseníase deverão ser examinados.
Após feito o exame clinico dos familiares, eles serão encaminhados para tratamento, caso estejam doentes, ou liberados com a correspondente orientação sobre a doença: período de incubação, transmissão,sinais e sintomas e retorno ao serviço de saúde sempre que necessário.
Além das orientações, os contatos intradomiciliares deverão ser
encaminhados para realização da vacina BCG. Esta vacina, também usada contra
a Tuberculose, aumenta a resistência das pessoas contra a Hanseníase. Devem
ser aplicadas duas doses da vacina BCG, por via intradérmica, com intervalo de
seis meses entre as doses.
A equipe de saúde deve preparar-se não apenas para atividades de
assistência individual ao doente, mas também para desenvolver a prática
educativa com os pacientes, seus familiares e com a comunidade
Fonte:National Geographic / Compreendendo a hanseníase como doença.